La Commissione tecnico scientifica dell'Agenzia italiana del farmaco ha autorizzato i due antivirali per il trattamento di pazienti Covid non ospedalizzati con malattia lieve-moderata di recente insorgenza e con condizioni cliniche concomitanti che rappresentino specifici fattori di rischio per lo sviluppo della malattia grave
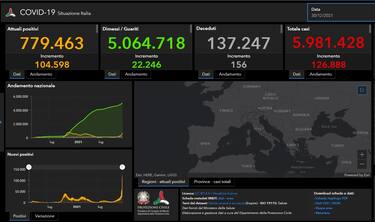
È arrivato il via libera dell'Agenzia italiana del farmaco alla pillola anti-Covid molnupiravir di Merck e all'antivirale remdesivir nella terapia contro il coronavirus. Lo ha annunciato la stessa Aifa in una nota, dove precisa che la sua Commissione tecnico scientifica (Cts) ha autorizzato i due antivirali per il trattamento di pazienti Covid non ospedalizzati con malattia lieve-moderata di recente insorgenza e con condizioni cliniche concomitanti che rappresentino specifici fattori di rischio per lo sviluppo della malattia grave. (COVID: LE ULTIME NOTIZIE IN DIRETTA - VACCINO COVID: DATI E GRAFICI SULLE SOMMINISTRAZIONI IN ITALIA, REGIONE PER REGIONE)
Molnupiravir sarà distribuito dal 4 gennaio
Nella nota, l'Aifa ricorda che la pillola anti-Covid molnupiravir di Merck è un antivirale orale, già autorizzato per una distribuzione in condizioni di emergenza con decreto del ministero della Salute del 26 novembre 2021. Il suo utilizzo è indicato entro 5 giorni dall'insorgenza dei sintomi. Il trattamento prevede l'assunzione di 4 compresse (da 200 mg) 2 volte al giorno, per 5 giorni. La pillola anti-Covid molnupiravir di Merck sarà distribuita da parte "della Struttura Commissariale alle Regioni dal 4 gennaio e per la sua prescrizione è previsto l'utilizzo di un Registro di monitoraggio che sarà presto accessibile online sul sito dell'Agenzia", precisa l'Aifa.
Il trattamento con remdesivir
Remdesivir, invece, può essere utilizzato fino a 7 giorni dall'insorgenza dei sintomi e la durata del trattamento, che consiste in una somministrazione endovenosa, è di 3 giorni. Per questo farmaco, "è stata recentemente autorizzata da Ema un’estensione di indicazione relativa al trattamento dei soggetti non in ossigeno-terapia ad alto rischio di Covid-19 grave. Anche per questa nuova indicazione è previsto l'utilizzo di un Registro di monitoraggio che è accessibile sul sito dell'Agenzia dal 30 dicembre 2021", precisa l'Aifa.
)
)
)
)
)